21.07.2022
Глобальная проблема бактериальной резистентности
Согласно недавнему отчету Всемирной организации здравоохранения (ВОЗ), устойчивость микроорганизмов к антибиотикам следует рассматривать как глобальную угрозу, сравнимую с изменением климата и терроризмом
Скорость развития резистентности к антибиотикам увеличивается. До недавнего времени новое лекарство можно было широко применять в течение примерно 10 лет или дольше до появления устойчивых бактерий, за исключением Staphylococcus aureus, у которого уже через несколько лет после введения метициллина развивалась резистентность. Сегодня некоторые бактерии развивают устойчивость к новым антибиотикам уже через несколько лет, как оказалось для левофлоксацина (введенного в 1996 г.) и линезолида (введенного в 2000 г.). Среди микробов, устойчивых к лекарствам, основную угрозу представляет группа под названием ESKAPEE, аббревиатура от Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp. и Escherichia coli, с уровнем резистентности от высокого до критического. По оценкам Всемирной организации здравоохранения данные патогены относятся к категориям I и II (высокий и критический уровень приоритетности).
Медицина и производство продуктов питания в значительной степени зависят от эффективного использования антибиотиков. Деятельность человека в ответ на индустриализацию резко увеличила распространённость остатков антибиотиков в продуктах питания и окружающей среде, а также развитие и распространение устойчивых к антибиотикам бактерий вместе с их генами устойчивости. Наиболее важным фактором, влияющим на возникновение и распространение устойчивости к антибиотикам, является их чрезмерное применение в медицине и сельском хозяйстве. Как сообщается в совместной публикации EFSA (Европейское агентство по безопасности пищевых продуктов), ECDC (Европейский центр профилактики и контроля заболеваний) и EMA (Европейское агентство по лекарственным средствам) с использованием данных за 2011 и 2012 годы, потребление антибиотиков животными гораздо выше, чем людьми. Устойчивые к антибиотикам бактерии, ассоциирующиеся с животными, могут быть патогенными для человека. Они легко передаются людям посредством пищевой цепочки и попадают в окружающую среду через отходы животных. При использовании навоза в качестве удобрения, бактерии из навоза и почвы обмениваются генами устойчивости, формируя новый бактериальный генотип почвы.
Резистентные бактерии выщелачиваются из почвы в воду и поглощаются растениями, что приводит к повышению уровня устойчивости к антибиотикам других бактериальных сообществ.
Неизбирательное использование антибиотиков вызывает селективное давление, позволяя процветать только наиболее приспособленному генотипу. Многие бактерии (патогенные, мутуалистические или комменсалы) имеют несколько хозяев (хостов), как человека, так и животных, включая большое количестко видов домашнего скота и диких животных. Escherichia coli — очевидный пример такого вида патогенов. Решение проблемы устойчивости к противомикробным препаратам в одной среде, например в клинике, окажется неэффективным, учитывая, что у бактерий имеются мобильные генетические элементы (MGE), а сами противомикробные препараты перемещаются между людьми, животными и окружающей средой.
Неизбирательное использование антибиотиков вызывает селективное давление, позволяя процветать только наиболее приспособленному генотипу. Многие бактерии (патогенные, мутуалистические или комменсалы) имеют несколько хозяев (хостов), как человека, так и животных, включая большое количестко видов домашнего скота и диких животных. Escherichia coli — очевидный пример такого вида патогенов. Решение проблемы устойчивости к противомикробным препаратам в одной среде, например в клинике, окажется неэффективным, учитывая, что у бактерий имеются мобильные генетические элементы (MGE), а сами противомикробные препараты перемещаются между людьми, животными и окружающей средой.
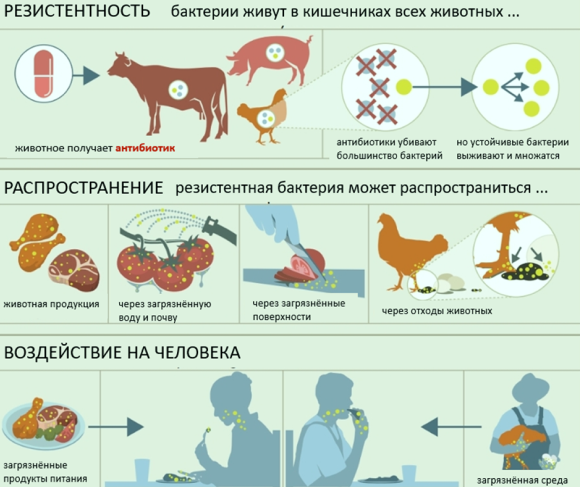
Этот вид устойчивости делает субпопуляцию нормально восприимчивых бактерий резистентной к определенному лекарству или даже к группе лекарств из-за генетического изменения. Это генетическое изменение может произойти через одну либо несколько точечных мутаций в конкретном гене, либо путем приобретения гена устойчивости посредством горизонтального переноса генов.
Особое опасение вызывает приобретённая устойчивость патогенов к антибиотикам.
Горизонтальный перенос генов – это особенно опасное явление, поскольку оно может происходить между большим количеством различного типа бактерий и почти во всех матрицах (в почве, воде, кишечнике или продуктах питания). В горизонтальном переносе гены могут передаваться как между разными бактериальными штаммами, так и между разными видами. Горизонтальный перенос гена устойчивости к антибиотикам чаще всего происходит посредством конъюгации - передачи ДНК между бактериальными клетками посредством прямого контакта между донорской и реципиентной клетками. Гены, передаваемые посредством конъюгации, располагаются на мобильных генетических структурах, например плазмидах и интегративных конъюгативных или подвижных элементах, например транспозонах или геномных островках. Все эти мобильные генетические структуры могут быть очень гибкими по генетическому содержанию за счет встраиваемых последовательностей и интегронов. Интегроны сами по себе не подвижны, но они могут либо располагаться на мобильных элементах, таких как транспозоны или плазмиды, либо интегрироваться в хромосому; они способны захватывать или высвобождать генные кассеты и могут принадлежать к разным классам. Интегроны связаны с мультирезистентностью штамма (когда штамм устойчив к нескольким антимикробным препаратам). В этих мультирезистентных штаммах интегрон может (но не всегда) содержать разные гены, которые кодируют разные механизмы устойчивости. Примером является клон мультирезистентной Salmonella Typhimurium, который проявляет устойчивость к различным противомикробным препаратам, принадлежащим к разным группам, таким как ампициллин, хлорамфеникол, флорфеникол, стрептомицин, сульфонамиды и тетрациклин.
Использование антибиотиков в ветеринарной или клинической практике оказывает давление отбора, которое ускоряет возникновение и распространение устойчивости к антибиотикам. Это может привести к клональной экспансии уже существующего устойчивого (патогенного) клона, что провоцирует серьезные осложнения для лечения, а также риск глобального распространения. Этот вид распространения называется вертикальной передачей устойчивости, при которой каждые две дочерние клетки получают копии генетического материала (включая гены устойчивости) или мутации, вызывающие устойчивость, от материнской клетки.
Горизонтальный перенос генов, в свою очередь, приводит к горизонтальному распространению устойчивости к реципиентным клеткам, которые не всегда связаны с популяцией доноров. Это означает, что так называемые безвредные комменсальные бактерии, как например кишечная палочка в кишечнике животных, могут нести гены устойчивости, такие как бета-лакматазы расширенного спектра (ESBL). Эти гены устойчивости затем могут быть переданы через горизонтальный перенос генов другим бактериям, таким как E. coli, другим членам семейсва энтеробактерий или даже неродственным бактериям, которые обитают в различных экологических нишах, таких как агропищевая цепь и кишечник человека. Было обнаружено, что штаммы бактерий E. coli, вырабатывающих бета-лактамазу расширенного спектра, присутствуют в курином мясе и у людей. Это предполагает обильное присутствие генов ESBL в пищевой цепи, что несомненно повлияет на расширение спектра инфекций, вызванных грамотрицательными бактериями и на их лечение в будущем.
Растущая устойчивость микроорганизмов к обычным химическим веществам и лекарствам побудила ученых искать новые источники биоцидов с широким спектром действия. Использование натуральных компонентов в лечебных целях в настоящее время является процветающей тенденцией. Натуральные компоненты рассматриваются как привилегированная группа структур, которые способны взаимодействовать с широким спектром белков для определенных целей. Эфирные масла, в частности, обладают различными биологическими свойствами, такими как противовоспалительное, седативное, пищеварительное, противомикробное, противовирусное, антиоксидантное, а также цитотоксическое действие. Этим объясняется растущий научный интерес именно к этой группе натуральных компонентов, потому что они представляют особую группу возможных новых лекарственных соединений из-за их химической и структурной вариативности, которая делает их функционально универсальными. Последние исследования подтверждают, что эфирные масла обладают сильным потенциалом прямого уничтожения патогенов и повторной
сенсибилизации для повышения эффективности антибиотиков.
сенсибилизации для повышения эффективности антибиотиков.
Фитогенный биопрепарат «Phytogenix®»
Биопрепарат «Phytogenix®» представляет собой стабильное соединение эфирных масел, органических кислот и дополнительных компонентов растительного происхождения, тщательно подобранных для достижения оптимального синергизма в целях профилактики заболеваний бактериальной, вирусной и грибковой этиологии. Терпены, терпеноиды, фенилпропены и их соединения в составе биопрепарата «Phytogenix®» подавляют и замедляют рост бактерий, грибков и плесени, а также подавляют выработку токсичных бактериальных метаболитов и препятствуют образованию биоплёнок. Присутствие в составе органических кислот, в частности лактата, обеспечивает максимальное действие биопрепарата против грамотрицательных бактерий за счёт синергизма дествия органических кислот и компонентов эфирных соединений.
Эффективность пртивомикробного действия отдельных компонентов в составе биопрепарата «Phytogenix®» и синергизм их взаимодействия научно доказаны против ряда патогенов и связанных с ними заболеваний:
Эффективность пртивомикробного действия отдельных компонентов в составе биопрепарата «Phytogenix®» и синергизм их взаимодействия научно доказаны против ряда патогенов и связанных с ними заболеваний:
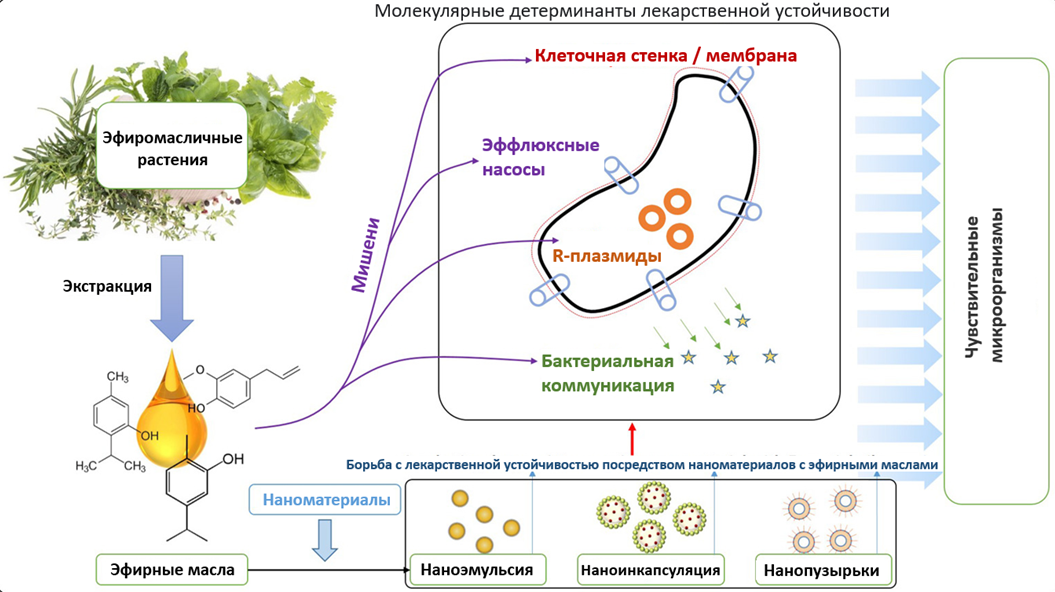
Механизм действия биопрепарата «Phytogenix®»
На сегодняшний день описано несколько механизмов действия эфирных масел и органических кислот на бактериальные клетки, однако все они сводятся к способности эфирных масел и органических кислот влиять как на внешнюю оболочку клетки, так и на цитоплазму. Типичная для эфирных масел гидрофобность ответственна за разрушение бактериальных структур, что приводит к повышенной проницаемости из-за неспособности отделить эфирные соединения от мембраны бактериальной клетки. Барьер проницаемости, обеспечиваемый клеточными мембранами, необходим для многих клеточных функций, включая поддержание энергетического статуса клетки, связанные с мембраной процессы преобразования энергии, транспортировку растворенных веществ и регуляцию метаболизма. Клеточная мембрана также важна для контроля тургорного давления. Антимикробная активность эфирных масел обычно объясняется токсичным воздействием эфирных компонентов на структуру и функцию мембран патогенных клеток. Механизмы действия эфирных масел включают разрушение клеточной стенки, повреждение цитоплазматической мембраны, коагуляцию цитоплазмы, повреждение белков мембраны, повышенную проницаемость, ведущую к утечке содержимого клеток, снижение протонной движущей силы, уменьшение внутриклеточного пула АТФ за счет снижения синтеза АТФ и усиленного гидролиза, который не связан с повышенной проницаемостью мембраны, и снижение мембранного потенциала за счет увеличения проницаемости мембраны. Органические кислоты в составе биопрепарата «Phytogenix®», в частности лактат, максимально увеличивают эффективность биопрепарата против грамотрицательных бактерий, наружная мембрана которых состоит из двойного слоя фосфолипидов, связанных с внутренней мембраной липополисахаридами, что делает её малодоступной для большинства эфирных масел. Небольшая водорастворимая молекула молочной кислоты проникает в периплазму через заполненные водой белки поринов внешней мембраны, нарушая барьер проницаемости мембраны, разрушая впоследствии слой липополисахаридов. Данный процесс способствует оптимальному проникновению компонентов эфирных соединений в патогенную клетку, что приводит к её деградации.
Важно заметить, что синергизм активных компонентов в составе биопрепарата «Phytogenix®» в разы снижает минимальные ингибирующие концентрации составляющих биопрепарата, наделяя его максимальной эффективностью в малых дозах.
Важно заметить, что синергизм активных компонентов в составе биопрепарата «Phytogenix®» в разы снижает минимальные ингибирующие концентрации составляющих биопрепарата, наделяя его максимальной эффективностью в малых дозах.
Синергизм биопрепарата «Phytogenix®» и антибиотиков
Экстракты растений, состоящие из сложных смесей основных соединений и их вторичных метаболитов, обладают синергическим действием с обычными антибиотиками. Комбинированная терапия, сочетающая обычные антибиотики и эфирные масла, в настоящее время процветает и представляет собой потенциальную область для будущих исследований. Это новое поколение фитофармацевтических препаратов может пролить свет на разработку новых фармакологических режимов борьбы с устойчивостью к антибиотикам.
Научные исследования подтверждают, что активные компоненты в составе биопрепарата «Phytogenix®» обладают синергическим действием с обычными антибиотиками, в частности карвакрол и тимол в сочетании с гентамицином проявили синергизм против B. cereus, B. subtilis и S. Aureus, а также против метициллин-чувствительного золотистого стафилококка в сочетании с ванкомицином. Терпинен-4-ол и п-цимен в сочетании с гентамицином проявили синергизм против E. coli, Yersinia enterocolitica, Serratia. marcescens и S. aureus. Гвоздичное масло проявило синергизм в сочетании с ампициллином и гентамицином против таких патогенов, как Streptococcus mutans, S. sobrinus, Streptococcus gordonii, Streptococcus sanguinis, S. criteci и Porphyromonas gingivalis. Линалоол и п-цимен в составе эфирных масел тимьяна и розмарина проявили синергизм с гентамицином, хлорамфениколом, ципрофлоксацином и тетрациклином против Acinetobacter baumannii, бактерии, относящейся по оценке ВОЗ к 1 категории приоритетности (критически высокий уровень приоритетности) по разработке новых антибиотиков в связи с резистентностью.
Научные исследования подтверждают, что активные компоненты в составе биопрепарата «Phytogenix®» обладают синергическим действием с обычными антибиотиками, в частности карвакрол и тимол в сочетании с гентамицином проявили синергизм против B. cereus, B. subtilis и S. Aureus, а также против метициллин-чувствительного золотистого стафилококка в сочетании с ванкомицином. Терпинен-4-ол и п-цимен в сочетании с гентамицином проявили синергизм против E. coli, Yersinia enterocolitica, Serratia. marcescens и S. aureus. Гвоздичное масло проявило синергизм в сочетании с ампициллином и гентамицином против таких патогенов, как Streptococcus mutans, S. sobrinus, Streptococcus gordonii, Streptococcus sanguinis, S. criteci и Porphyromonas gingivalis. Линалоол и п-цимен в составе эфирных масел тимьяна и розмарина проявили синергизм с гентамицином, хлорамфениколом, ципрофлоксацином и тетрациклином против Acinetobacter baumannii, бактерии, относящейся по оценке ВОЗ к 1 категории приоритетности (критически высокий уровень приоритетности) по разработке новых антибиотиков в связи с резистентностью.

